基因驱动——让蚊子自我灭绝(一)
花生 @ 2018.11.13 , 02:00 下午“我好像打到了。”Alekos Simoni露出一抹微笑,把昵称为“刽子手”的电蚊拍放回金属架子上。他只是手腕轻轻一抖,一只经过基因改造的蚊子就瞬间化为一道象征对自由渴望的亮光。蚊子想要离开伦敦帝国大学的这间地下实验室,还要经过重重障碍,但其中最痛快的莫过于“刽子手”。
Simoni博士工作的实验室致力于消灭蚊子,虽然往往不那么血肉横飞,但是比电蚊拍影响更加长远。实验室中的蚊子都被插入了一小段名为“基因驱动(gene drive)”的DNA。和普通的基因工程不同,基因驱动在插入染色体后会主动传播,因此会在种群中几何级数地传播。如果插入的基因驱动表现出有害性状,理论上整个物种会逐渐灭绝。

人类主动而有意识地灭绝一个物种是很困难的,但并非没有先例:1980年天花病毒在自然环境中灭绝了(译者注:某几个国家的某些实验室还保留着一些样本)。此前的80年间,天花病毒已经带走了3亿条鲜活的生命,此前的死亡人数更加难以计量,而凶手就在1980年被彻底灭绝了。如果伦敦帝国大学或者其他机构研究的基因驱动被用于根除传播疟疾的蚊子,那么人类历史上第二大外敌即将成为历史。
消灭疟疾并不是终点,理论上基因驱动可以用在“能够短时间有性繁衍出大量后代”而且“会四处移动”的任何物种上。传播利什曼病(黑热病)、美洲锥虫病、登革热、切昆贡亚热、非洲锥虫病和寨卡病毒的蚊虫都可以成为目标。同理,不伤害人类本身,却损害人类利益的物种也能被根除。加州大学圣迭戈分校的生物学家研制了针对樱桃果蝇的基因驱动,樱桃果蝇原产于亚洲,后来入侵美洲与欧洲,损毁大量当地浆果与水果作物。国际环保组织Island Conservation认为基因驱动可以用来“人道而有效”地处理新西兰与夏威夷的入侵物种,例如老鼠和白鼬。
当然,并非所有人都持乐观态度。其他环保组织认为基因驱动难以被限制在一个地区,如果插入“入侵物种“的基因驱动反过来传播到原产地怎么办?如果被植入基因驱动的物种在生态环境中其实起到了相当重要的作用,但是人们以前并不知道;或者基因驱动传播到血缘关系相近的物种(或者亚种),灭绝了无害甚至有益的物种怎么办?贸然插入基因驱动可能对生态造成不可逆的损害。
反对者认为,剿灭疟疾,拯救每年因此而死的44.5万人(大部分是儿童)是值得鼓励的,但他们担心这个先例会给不那么“干净”的基因驱动应用大开方便之门,例如工业化的农业公司会用这个技术获利,却挤占了其他农业从业者的利益。他们也担心基因驱动会被军方利用——基因驱动既可以在整个种群中传播致死基因,也可以让整个种群对人类构成更大危险。
“没什么问题嘛”
人们常对突破性的技术一皱眉,甩一句:“把自己当成上帝了。”对于基因驱动技术尤其如此,随心所欲地灭绝一个物种——或者说,让他们自我灭亡——对于普罗大众而言,和凭空创造一个物种没什么区别,远远超出了他们所习惯的人类能力的范围。
基因驱动就本身而言,是一种尤其“自私”的基因。大多数动物的大部分染色体都有一对,分别来自父亲与母亲。但动物形成配子(精子或卵子)时,在一对染色体中只会选一个放进去,要么放父方的,要么放母方的。但有些基因可以进入超过50%的配子,也就是说下一代中超过一半会带有这个基因。
1960年,美国昆虫学家George Craig发现这种基因可以用来控制传播疾病的蚊子的数量,比如说提高后代中雄蚊子的比例。2003年,伦敦帝国大学的Austin Burt猜想有一种基因驱动,可以在一对染色体的相同位置进行切割,然后把自己整合进去,如果一切顺利,可以灭绝一整个物种。
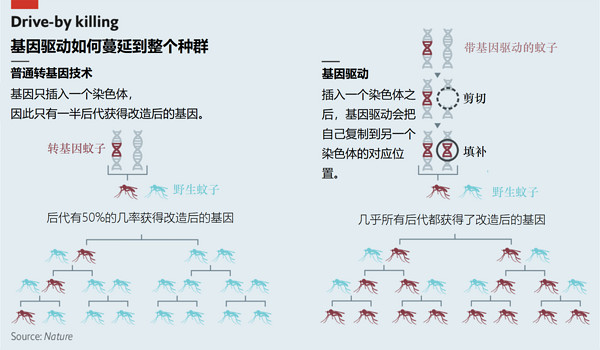
想法很不错,但是很难实现——直到2012年,人类学会了使用CRISPR-Cas9来编辑基因。基于CRISPR-Cas9的基因驱动可以轻易被编辑成移除特定染色体的特定片段,然后取而代之,保证每一个配子都包含基因驱动(如上图)。截至2016年,我们已经创造了适用于酵母、果蝇和两种文字的基因驱动。《自然生物技术》九月刊中,Andrea Crisanti、Austin Burt以及帝国大学的同事们发表了一篇文章,描述了他们在试验中使用基因驱动,灭除了一个封闭环境中的所有冈比亚按蚊——这是基因驱动的第一次实际使用,而下一步是在一个更大的封闭环境中进行试验(换一个更大的笼子,放进去更多按蚊)。
试验中使用的基因驱动修改了名为“doublesex”的基因,这个基因决定了蚊子的性别。只有一份基因驱动的蚊子会把基因驱动传给所有后代,而有一对基因驱动的雌蚊是不育的。用不育的蚊子控制蚊虫数量并不是什么新技术,我们以前释放过不育的蚊子,让野生蚊子和它们徒劳地交配。而基因驱动可以主动在种群中传播不育的基因。
进化机制可能对基因驱动不利——缺少基因驱动目标片段的蚊子会逃过一劫,而当它们没有基因突变的同伴们死光之后,他们会成为蚊群的主力军,基因驱动就失效了。但伦敦理工大学的研究员们早就想到了这一点,他们选择doublesex不是随机的,而是因为doublesex基因本身和蚊子的生育有关,如果doublesex突变之后失去了基因驱动的目标片段,很有可能它本身就废了——也正是因为这个原因,doublesex在蚊子的演变史中就没怎么改变过。因此对基因驱动产生抗性的蚊子很大几率本来就不能生育,也无从传给下一代了。
帝国理工大学的科学家们是“目标:疟疾”研究联盟的成员,这个联盟由“比尔与梅琳达·盖茨基金会”与“开放慈善项目基金”赞助,自2005年创立以来,每年收到赞助500万美元。“目标:疟疾”已经在布基纳法索、马里和乌干达准备进行基因驱动的大规模试验。这些地区已经使用了包括蚊帐、杀虫剂、抗疟药物(杀死病人血液中的疟原虫,以免蚊虫把他们身上的疟原虫传播出去)。试验地区有了这些保险措施,即使真的出现了对基因驱动有抗性的蚊子,疟原虫的传播循环也会被完全摧毁。如果试验成功,整个非洲的疟疾都会被根除——现在全球90%的疟疾病例在非洲。
本文译自 the Economist,由 花生 编辑发布。
PREV : 调查进一步揭示了导致儿童近视的几个因素
NEXT : 5个源于古代的英语习语和习俗