东皮埃蒙特大学的研究揭示了内质网中钙离子平衡与蛋白质折叠的生死联动。这种轴线的失调是导致神经退行、心脏病和癌症等重大疾病的核心。
在我们的细胞深处,有一个繁忙的生产车间兼仓库,它被称为内质网。这个地方不仅负责生产我们生命活动所需的蛋白质,还储存着大量的钙离子。东皮埃蒙特大学的科学家 Elia Ranzato 和 Simona Martinotti 在2026年发表于《细胞》杂志的一篇综述中指出,这两个看似不相关的功能,实际上共用着一套精密的生死轴线。
内质网的运作高度依赖钙离子。你可以把钙离子想象成维持工厂机器运转的动力源,像 BiP/GRP78 这样的分子伴侣,必须在含钙量处于100到500微摩尔的环境下才能正常工作,帮助蛋白质折叠成正确的形状。一旦钙离子水平下降,蛋白质的生产就会陷入混乱,出现大量“次品”或“废品”,这就是所谓的内质网应激。
面对危机,细胞并不会坐以待毙,它会启动一套名为未折叠蛋白质反应(UPR)的应急系统。这套系统由三个传感器 PERK、IRE1α 和 ATF6 组成。在初期,它们像急救员一样,尝试通过放慢生产速度、招募更多修理工来解决问题,努力恢复平衡。
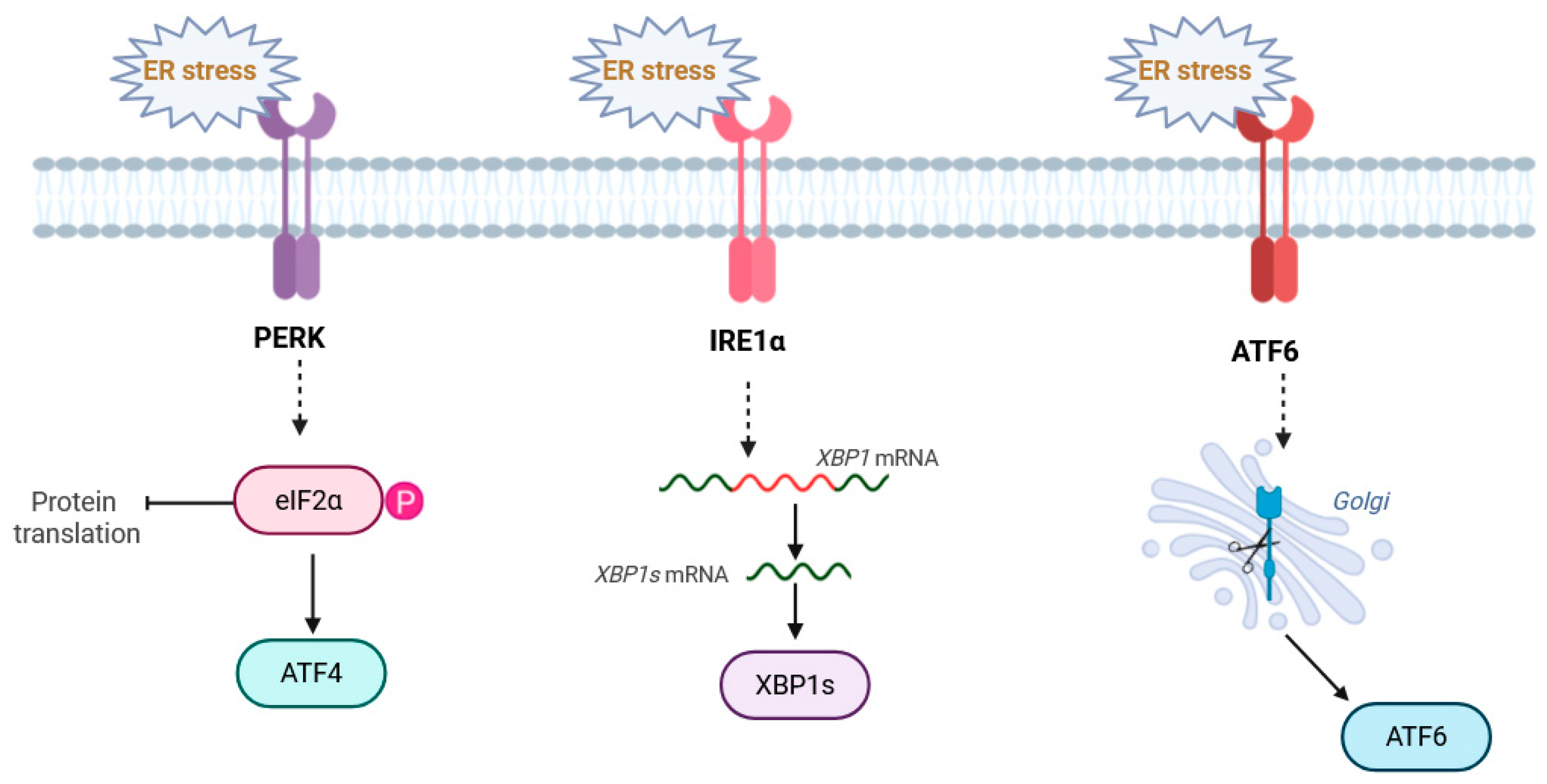
然而,如果压力持续存在,这套救灾系统就会发生可怕的逆转。特别是当一个叫 CHOP 的蛋白质被过度激活时,它不再尝试修补,而是按下自杀开关。CHOP 会抑制钙泵(SERCA)的功能,导致钙离子进一步流失,让内质网陷入更深的枯竭。这种恶性循环最终会把细胞推向死亡。
这种微观层面的失衡,是许多人类重大疾病的共同根源。在阿尔茨海默病或帕金森病等神经退行性疾病中,大脑细胞长期处于这种低强度的压力下。错误的蛋白质不断累积,导致钙泵效率低下,神经元最终因为无法承受这种持续的折叠压力而凋亡。
心脏病的情况则更加紧迫。在心力衰竭中,钙离子会从仓库中“泄漏”出来。这不仅让肌肉收缩无力,还会引发内质网应激,通过 CHOP 进一步压制钙泵,形成一个让心脏功能不断恶化的死循环。在心肌梗死发生时,过载的钙离子甚至会冲进线粒体,引发大规模的细胞死亡。
有趣的是,癌细胞展现出了完全不同的“智慧”。它们为了在缺氧和营养匮乏的恶劣环境中生存,会恶意劫持 UPR 系统。它们通常会保持救灾系统的“修复模式”持续开启,同时避开自杀模式,从而维持自己的无限扩张。目前,科研人员正在尝试通过抑制这种修复模式,强行开启癌细胞的自杀开关。
Elia Ranzato 和 Simona Martinotti 强调,未来的治疗方向不应只是简单地抑制某一个信号,而应像调节天平一样,寻找能重新平衡钙离子的“调节器”。通过激活钙泵或有针对性地阻断 CHOP 路径,我们或许能从根源上治愈这些困扰人类的顽疾。
