线粒体不仅是细胞的能量工厂,更是信息处理与社交的核心。它们通过融合与信号传递支持生命健康,饮食与运动可优化其功能,助力长寿与幸福。
我一直渴望探寻生命的奥秘:是什么驱动我们前行?是什么让我们愈合并蓬勃发展?当我们生病或最终停止呼吸时,又是什么出了问题?这些宏大的问题引领我走向了线粒体,仿佛命中注定。
在从高中到大学的生物课上,我学到线粒体是细胞内的小型“发电厂”,将氧气与食物结合,产生身体所需的能量。我曾以为它们不过是细胞里的小电池,平凡得像手机充电器。直到2011年,我在英国纽卡斯尔一个昏暗的实验室里,独自通过显微镜观察线粒体。那一刻,它们被荧光染料点亮,呈现出令人惊叹的动态美——不断移动、拉伸、变形,彼此触碰,宛如一场微观的舞蹈。我被深深震撼,从此成了“线粒体痴迷者”。
生物学家Lynn Margulis的洞见为我的观察提供了启发。她在1967年提出,线粒体源于约15亿年前被较大祖先细胞吞噬的细菌。这种共生关系——她称之为“内共生”——并非掠食,而是合作。宿主细胞缺乏利用氧气的能量来源,而线粒体填补了这一空白。这场奇妙的结合让细胞学会了沟通与协作,突破了自身界限,为多细胞动物的复杂生命奠定了基础。线粒体让细胞变得“社交”,通过相互依赖的契约,促成了我们的存在。
更令人惊奇的是,我和同事发现,线粒体本身就是社交的先行者。它们继承了细菌的生命周期:老的线粒体消亡,新的从现有线粒体中诞生。每个细胞内,线粒体群聚在细胞核周围,宛如一个微型社区。它们通过分子信号在细胞内外交流,在需要时互相支持,共同维持社区的繁荣。线粒体产生热量,让我们保持温暖;它们感知环境信号,如空气污染或压力触发因素,整合信息后发出分子信号,调控细胞乃至全身的运作。
当线粒体健康时,我们也随之焕发活力。但若它们功能失调——比如无法将能量转化为生化反应所需的形式——我们可能面临糖尿病、癌症、自闭症或神经退行性疾病的困扰。随着时间推移,压力和其他伤害累积,线粒体缺陷加剧,导致衰老,最终走向死亡。要理解健康与疾病的根源,我们需要深入探索线粒体的社交生活。
早在观察线粒体之前,我就熟知它们的基本结构。我们从母亲的卵细胞继承线粒体,它们拥有自己的DNA,仅含37个基因,远少于细胞核内成千上万的基因。这环状的线粒体DNA(mtDNA)被双层膜保护。外膜像香肠皮,控制分子进出;内膜布满密集的蛋白质,褶边称为“嵴”,是化学反应的场所,类似电池中的极板。
1960年代,英国生物化学家Peter Mitchell和Jennifer Moyle揭示了线粒体的能量奥秘:食物中的碳原子提供电子,在嵴上与氧气结合,释放出能量火花,形成跨膜电势差。这个电压驱动身体和大脑的一切活动,从保暖到制造分子,再到思考。线粒体还生产三磷酸腺苷,一种便携的能量单位,驱动细胞内数百种生化反应。
回到美国后,我在费城儿童医院的线粒体与表观遗传医学中心跟随Douglas Wallace进行博士后研究。1988年,Wallace首次发现mtDNA突变与人类疾病的关联,奠定了线粒体医学的基础。我与同事Meagan McManus合作,研究线粒体缺陷如何引发心血管和神经疾病。她让我用电子显微镜拍摄携带特定mtDNA突变的小鼠心脏线粒体,这些突变会导致心力衰竭。
我们还尝试了电子断层扫描技术,类似放射科医生用来观察人体内部的三维成像。几周后,项目负责人Dewight Williams带我走进宾夕法尼亚大学一间摆放着价值百万美元显微镜的房间,展示线粒体的三维重建影像。画面令人震撼:病鼠心脏线粒体的嵴呈锯齿状,极不规则。但出乎意料的是,在线粒体相互接触的区域,嵴看起来健康,数量也更多。我兴奋地冲回实验室,喊来McManus:“线粒体在互相影响!”我们反复观看视频,她激动地指出:“嵴还在对齐!线粒体之间的嵴竟然对齐了!”
此前,我研究了无数显微图像,从未听说线粒体嵴会跨细胞对齐。1983年,俄罗斯科学家Lora E. Bakeeva和Vladimir P. Skulachev曾描述过“线粒体间接触”,我还发现运动后这些接触会增加,或许提高了能量效率。但嵴的对齐却是个新发现。它们不像教科书中的平行板,而是如丝带般在细胞间起伏,仿佛在帮助邻居维持健康的排列。我提出,嵴中的铁硫簇可能具有顺磁性,电荷流动诱发的电磁场使嵴对齐。这不仅解释了嵴的排列,还让我思考物理力量如何推动多细胞生命的演化。
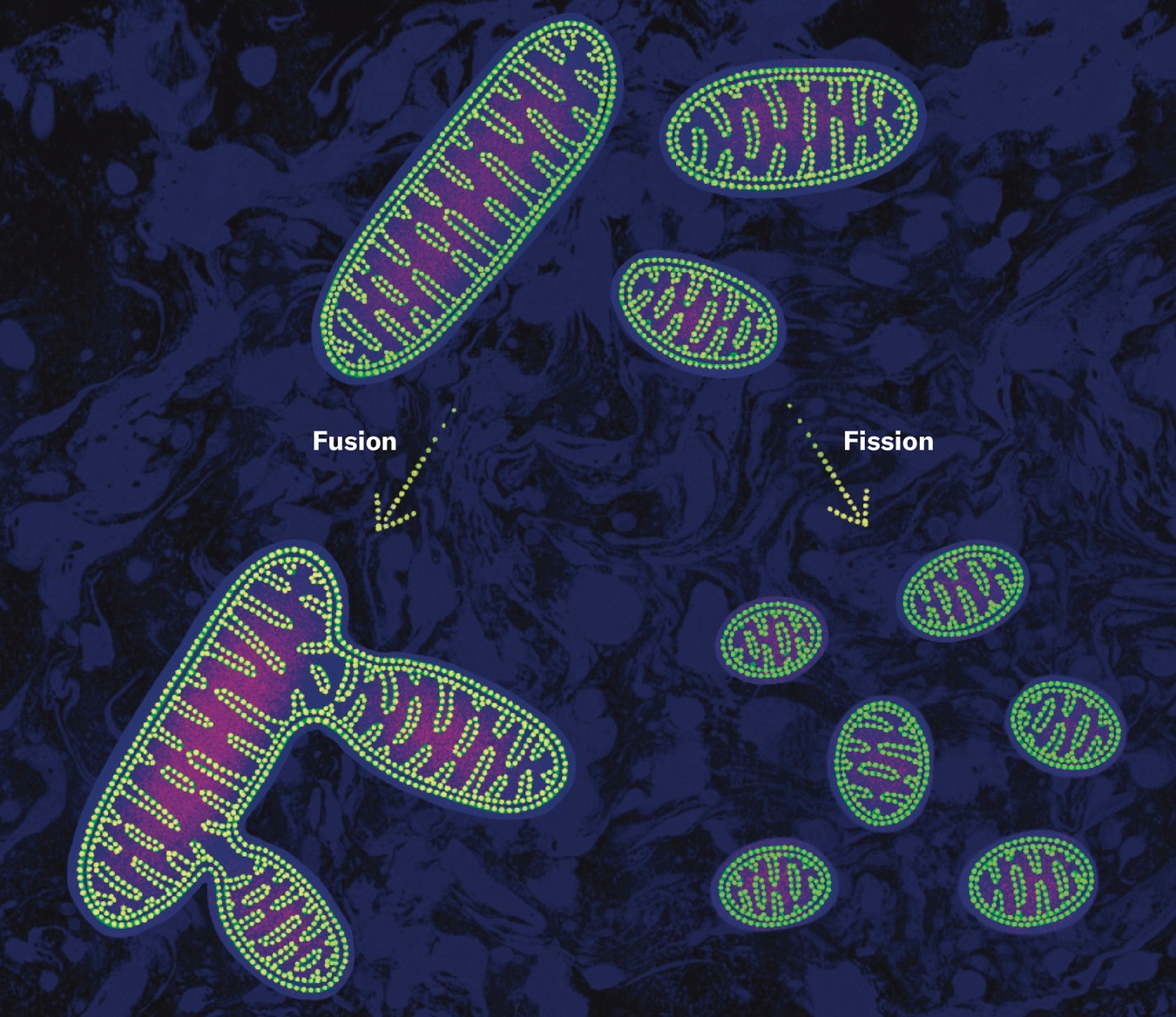
这一发现彻底改变了我对线粒体的认知。在日本筑波大学等地进一步研究显示,健康线粒体可向突变线粒体捐献完整的mtDNA。在能量匮乏时,线粒体会融合成细长链条,共享DNA。孤立的或突变的线粒体也能与健康线粒体融合,恢复正常功能。融合增强了线粒体和细胞的韧性,阻断融合则导致DNA缺陷累积,细胞死亡。人类中,线粒体外膜的融合蛋白2减少与神经退行性疾病相关;在小鼠脑部的伏隔核中,阻碍融合的线粒体会增加焦虑。
线粒体是否还有其他交流方式?它们是否像细菌祖先那样,通过膜突起、电磁场或分泌分子协作?2016年,我在哥伦比亚大学成立实验室后,回到纽卡斯尔的威尔康姆线粒体研究中心,与研究生Amy Vincent合作。我们观察了一位患有线粒体疾病女性的小腿肌肉,发现她的线粒体形成了“纳米隧道”——类似细菌用来分享DNA的细长膜突起。这是首次在人类中发现线粒体通过这种方式交流。进一步研究显示,功能较差的线粒体拥有更多纳米隧道,仿佛在向健康线粒体求助。
更令人惊叹的是,线粒体通过激素跨身体部位对话。肾上腺的线粒体产生皮质醇,调控压力反应;生殖器官的线粒体合成睾酮、雌激素和孕酮。大脑线粒体则能感知这些激素,形成跨器官的沟通网络。此外,线粒体因细胞类型而异:形态、蛋白质组成、移动方式各不相同。这种特化提高了效率,让生物以更低的能量成本生存。
我们最近绘制了人类大脑线粒体的首张地图,发现不同脑区的线粒体各具特色。大脑消耗20%的身体能量,尽管只占体重的2%。与Michel Thiebaut de Schotten和Eugene V. Mosharov合作,我们发现进化较新的脑区拥有更高效的能量转换线粒体。神经元中的线粒体也各有分工:树突线粒体细长稳定,含多个DNA拷贝;轴突线粒体短小,常无DNA;细胞质线粒体则介于两者之间。
2021年,我与Carmen Sandi提出,线粒体是“社交细胞器”。它们在细胞内共享环境、沟通、形成群体、同步行为,并分担专业任务。与Orian S. Shirihai合作,我们审阅了400多篇研究,确认线粒体集体形成“线粒体信息处理系统”(MIPS),感知环境信号,通过嵴的膜电位整合信息,调控基因表达和细胞行为。就像眼睛将光转化为图像,耳朵将声波转为声音,线粒体将激素、代谢和化学信号转化为电势,再生成可被细胞核“读取”的分子信号。
线粒体不是电池,而是细胞的“主板”。基因在细胞核内静止,直到线粒体提供能量和信号,激活或关闭基因表达。Timothy Shutt将线粒体比喻为“细胞首席执行官”,掌控细胞分裂、转化或死亡。若MIPS认为必要,它会触发细胞凋亡,为机体整体利益牺牲个体细胞。
线粒体的重要性还体现在细胞间的“捐献”。在肿瘤中,癌细胞与免疫细胞争夺线粒体,视其为“生物武器”。由Jonathan R. Brestoff领导的国际团队为线粒体转移和移植研究建立了新术语。这对健康意味着什么?答案是:几乎一切。糖尿病、神经退行性疾病、癌症甚至精神疾病都与线粒体功能失调相关。
线粒体通过多种途径影响健康。首先,作为能量处理器,过多的葡萄糖或脂肪会导致线粒体分裂,DNA缺陷累积,加速细胞衰老或死亡。实验显示,阻止线粒体分裂可预防胰岛素抵抗。其次,线粒体信号影响66%以上的核基因表达,改变细胞行为和抗压能力。患有线粒体疾病的人,其嵴形态异常,呈现出类似“麦田怪圈”的怪异形状。这些异常在阿尔茨海默病、帕金森病和自闭症等疾病中被视为生物标志物。
第三,线粒体与炎症相关。压力或损伤可能导致mtDNA泄漏到细胞质或血液中,因其类似细菌DNA,触发免疫反应,诱发炎症。我与Caroline Trumpff等人发现,5分钟的公开演讲即可增加血液中游离mtDNA,重症患者体内水平更高。炎症与多种慢性疾病的发生和进展密切相关。
如何保持线粒体健康?运动是关键。剧烈运动激活线粒体膜电位,刺激其增殖与优化。气喘吁吁的感觉表明线粒体在全力工作,身体也会为此“备战”,生成更多高效线粒体。令人意外的是,社交联系也对大脑线粒体有益。David A. Bennett的研究显示,积极情绪(如目标感、乐观)与线粒体能量转换蛋白的水平相关,而压力和孤立则削弱其功能。
饮食是另一大助力。医学酮症疗法(低糖高脂饮食)可逆转胰岛素抵抗和2型糖尿病,稳定癫痫患者的脑功能,甚至改善阿尔茨海默病患者的认知与睡眠。加拿大人Lauren Kennedy West的经历令人振奋。她25岁时被诊断患有精神分裂症和双相情感障碍,生活一度无望。2023年12月,她开始酮症疗法,两周后感到更有活力,九个月后症状消失,逐步停药。这与一项21人试点试验的结果一致,显示酮症饮食对严重精神疾病有潜在疗效。
酮症饮食为何有效?从线粒体视角看,它提供高效燃料——酮体。肝脏线粒体将脂肪分解为酮体,供大脑等器官优先使用。酮体直接进入神经元线粒体,简化能量传递,促进线粒体间的“社交”。一项涉及28995人的研究显示,低糖饮食的人患抑郁症的概率不到高糖饮食者的一半。
将线粒体视为动态的能量与信息处理器,我们对生命的理解焕然一新。你不是静态的实体,而是一个流动的过程,宛如瀑布。瀑布的美不在于水分子,而在于流动。同样,你的健康与生命力取决于线粒体的能量流动。每次你拒绝甜食、散步、健身或与挚友相聚,你都在支持线粒体。让能量在这微观社区中顺畅流动,或许就是健康与意义人生的密钥。
本文译自 Scientific American,由 BALI 编辑发布。
